رازهای سلولهای بنیادی؛ درمانی معجزهآسا یا رویایی دور؟

در چند دهه اخیر، علم پزشکی در حال گشودن افقهای نوین در درمان بیماریها و بازسازی بافتها بوده است. یکی از این تحولات بزرگ، استفاده از سلولهای بنیادی است؛ سلولهایی با قابلیتهای شگرف که میتوانند به بازسازی بافتهای آسیبدیده کمک کنند و حتی درمانهای بالقوهای برای بیماریهای مزمن و لاعلاج همچون پارکینسون، آلزایمر، و ضایعات نخاعی ارائه دهند. اگرچه این حوزه نوین در مراحل پیشرفتهای قرار دارد، اما همچنان چالشهایی برای بهرهبرداری کامل از ظرفیتهای سلولهای بنیادی وجود دارد. طی گفتوگو آناتک با شیدا صادقی، استاد دانشگاه علوم پزشکی آزاد تهران و علوم تحقیقات به وجوه عیان و پنهان این حوزه پرداختهایم تا ابعاد مختلف این فناوری نوین را از نحوه استخراج سلولهای بنیادی گرفته تا کاربردهای درمانی آنها، را بررسی کنیم.
شیدا صادقی: در آزمایشگاه «سلولهای پرتوان القایی» از سلولهای معمولی بدن (مثل پوست) ساخته میشوند و میتوانند مثل سلولهای جنینی چندتوان باشند. این روش، انقلابی در پزشکی بازساختی ایجاد کرده، زیرا نیاز به استفاده از جنین را کاهش میدهد. ما میتوانیم سلولهای پوستی بیمار را بگیریم، با مهندسی ژنتیک آنها را به حالت پرتوان برگردانیم و بعد به هر نوع سلولی که نیاز داریم تبدیل کنیم. این روش برای ساخت جنینهای مصنوعی یا درمانهای شخصیسازیشده بسیار امیدوارکننده است
سلولهای بنیادی؛ آجرهای سازنده بدن
وقتی صحبت از سلولهای بنیادی میشود، گویی درباره مصالح اولیه بدن حرف میزنیم؛ سلولهایی که میتوانند به هر نوع بافت یا اندامی تبدیل شوند. اما این سلولها از کجا میآیند و چطور به دست میآیند؟
شیدا صادقی اینگونه توضیح داد: «سلولهای بنیادی، سلولهای تمایزنیافته با توان تقسیم بالا هستند که هنوز تقسیم نشدهاند؛ این سلولها طی فرایند میتوز تقسیم شده و با تمایز پیدا کردن، تخصصی میشوند. سلولها بنیادی در پستانداران دو نوع دارند جنینی و بالغ که دو ویژگی کلیدی دارند. قابلیت تکثیر نامحدود و توانایی تبدیل به انواع سلولهای تخصصی مثل سلولهای عصبی، خونی یا حتی عضلانی. این سلولها در بدن همه موجودات پرسلولی، از جمله انسان، بهصورت طبیعی وجود دارند. مدل یابی بیماری از دیگر مزایای سلولهای بنیادی است. این سلولها بر اساس نوع درمان، شرایط بیمار و اهداف درمانی از منابع مختلفی برداشت یا استخراج میشوند. این منابع یا به اصطلاح تخصصی کنامها در نقاط خاصی مثل مغز استخوان، بافت چربی، بند ناف، پوست و حتی پالپ دندان یافت میشوند.»
او ادامه داد: «سلولهای بنیادی به دو نوع اصلی تقسیم میشوند جنینی و بالغ. سلولهای جنینی از جنینهای ۳ تا ۵ روزه در مرحله بلاستوسیت به دست میآیند، یعنی همان جنینهایی که در فرآیند لقاح آزمایشگاهی (IVF) استفاده نشدهاند. این سلولها به دلیل توانایی تبدیل به انواع سلولهای بدن، چندتوان (pluripotent) هستند و کاربردهای گستردهای دارند. برای استخراج این سلولها، توده سلولی داخلی جنین را با ابزارهای میکروسکوپی جدا میکنیم و در محیط کشت آزمایشگاهی قرار میدهیم. در این محیط، با کنترل دما، رطوبت و افزودن فاکتورهای رشد، سلولها تکثیر میشوند و برای استفاده در درمان یا تحقیقات آماده میگردند.»
سلولهای بنیادی بالغ، اما داستان متفاوتی دارند. این سلولها در بافتهای توسعهیافته مثل مغز استخوان یا چربی وجود دارند و معمولاً تکتوان (unipotent) یا چندتوان محدود هستند، یعنی فقط به سلولهای همان بافت تبدیل میشوند.
صادقی مثال زد: «سلولهای بنیادی خونساز در مغز استخوان میتوانند به سلولهای خونی تبدیل شوند، اما نمیتوانند به سلول عصبی تبدیل شوند. این سلولها بیشتر برای ترمیم همان بافتی که از آن گرفته شدهاند استفاده میشوند.»
وی با اشاره به یک روش نوین گفت: «در آزمایشگاه «سلولهای پرتوان القایی» از سلولهای معمولی بدن (مثل پوست) ساخته میشوند و میتوانند مثل سلولهای جنینی چندتوان باشند. این روش، انقلابی در پزشکی بازساختی ایجاد کرده، زیرا نیاز به استفاده از جنین را کاهش میدهد. ما میتوانیم سلولهای پوستی بیمار را بگیریم، با مهندسی ژنتیک آنها را به حالت پرتوان برگردانیم و بعد به هر نوع سلولی که نیاز داریم تبدیل کنیم. این روش برای ساخت جنینهای مصنوعی یا درمانهای شخصیسازیشده بسیار امیدوارکننده است.»
اما استخراج سلولها چالشهایی هم دارد. به گفته استاد دانشگاه علوم پزشکی آزاد تهران، روشهای استخراج، بهویژه برای سلولهای بالغ، هنوز بهینه نیستند. خطر عفونت، ناسازگاری ایمنی و حتی انسداد وریدی کبدی از جمله مشکلاتی هستند که محققان با آن دستوپنجه نرم میکنند.
او گفت: «برای مثال، در پیوند مغز استخوان، سلولهای خونساز را از اهداکننده میگیرند، اما این فرایند ممکن است با رد پیوند یا عوارض همراه باشد. در روشهای دیگر، مثل استخراج از بافت چربی طی لیپوساکشن، نیاز به شستوشو و تیمارهای آنزیمی است که اینکار ریسکهایی دارد.»
کاربردهای امروزی؛ از سرطان تا بیماریهای قلبی
سلولهای بنیادی در حال حاضر در چه زمینههایی به کار میروند؟ این سوالی است که بسیاری از بیماران و محققان به دنبال پاسخش هستند.
شیدا صادقی درباره این موضوع گفت: «سلولهای بنیادی به دلیل توانایی تکثیر و تبدیل به سلولهای تخصصی، در درمان بیماریهایی که سلولها دچار نقص یا تخریب شدهاند، بسیار موثرند. امروز این سلولها در درمان بیماریهای خونی مثل لوسمی و لنفوم، بیماریهای قلبی، مشکلات استخوانی و حتی بیماریهای چشمی مثل آسیب قرنیه کاربرد دارند.» او به نمونههای ملموسی اشاره کرد. برای مثال، در درمان سرطانهای خونی، سلولهای بنیادی خونساز از مغز استخوان یا بند ناف اهداکننده گرفته میشوند و به بیمار پیوند زده میشوند تا سیستم خونسازی او بازسازی شود.
وی افزود: «در بیماریهای قلبی، سلولهای بنیادی میتوانند بافت آسیبدیده قلب را ترمیم کنند. در بیماریهای چشمی هم، سلولهای بنیادی برای بازسازی قرنیه یا درمان برخی انواع کوری استفاده شدهاند.»
اما کاربردهای سلولهای بنیادی به درمان محدود نمیشود. به گفته استاد دانشگاه علوم تحقیقات، این سلولها در پژوهشها نیز نقش مهمی دارند.
او ادامه داد: «ما از سلولهای بنیادی برای مدلسازی بیماریها استفاده میکنیم. مثلاً سلولهای عصبی ساختهشده از سلولهای بنیادی را در آزمایشگاه بررسی میکنیم تا اثر داروها را روی بیماریهایی مثل آلزایمر یا پارکینسون تست کنیم.»
با این حال، او هشدار داد که برخی درمانها هنوز در مراحل اولیه هستند. بیماریهایی مثل اوتیسم، فلج مغزی یا آلزایمر هنوز در مرحله کارآزمایی بالینی یا پیشبالینی هستند و نتایج قطعی برایشان وجود ندارد.
همچنین وی افزود: «سلولهای بنیادی یک فناوری جدیدند و راه طولانی در پیش دارند. اما هر روز که میگذرد، شواهد بیشتری از پتانسیل آنها به دست میآید.»
امید به فردا: دیابت، پارکینسون و فلج نخاعی
یکی از هیجانانگیزترین جنبههای سلولهای بنیادی، پتانسیل آنها برای درمان بیماریهایی است که تا دیروز لاعلاج به نظر میرسیدند. اما آیا واقعاً میتوان بیماریهایی مثل دیابت، پارکینسون یا فلج نخاعی را با این سلولها درمان کرد؟
دکتر صادقی پاسخ داد: «از نظر تئوری، بله، این امکان وجود دارد. سلولهای بنیادی میتوانند به سلولهای تخصصی مثل نورونها یا سلولهای تولیدکننده انسولین تبدیل شوند و بافتهای آسیبدیده را جایگزین کنند. اما در عمل، هنوز در مراحل اولیه هستیم.»
شیدا صادقی: در برخی بیماران، CAR-T بار تومور را کاهش میدهد، اما نمیتواند سرطان را کاملاً نابود کند. این میتواند به پیشرفت دوباره سرطان منجر شود چالشهای ایمنی هم کم نیستند. تولید انبوه سلولهای مهندسیشده دشوار است و تزریق آنها گاهی عوارضی مثل واکنشهای ایمنی شدید ایجاد میکند. ما در حال کار روی روشهایی هستیم که این عوارض را کاهش دهد، مثلاً با بهبود طراحی گیرندههای CAR یا ترکیب CAR-T با درمانهای دیگر
او با اشاره به پیشرفتهای اخیر در درمان دیابت نوع یک گفت: «در یک کارآزمایی بالینی در چین، محققان از سلولهای پرتوان القایی بیمار استفاده کردند تا سلولهای جزایر لانگرهانس (تولیدکننده انسولین) بسازند. در این آزمایش، یک زن ۲۵ ساله که ۱۱ سال دیابت نوع یک داشت، پس از دریافت این سلولها دیگر نیازی به تزریق انسولین نداشت. این یک موفقیت بزرگ بود و نشان داد که سلولدرمانی میتواند در دیابت موثر باشد.»
در مورد پارکینسون، داستان کمی پیچیدهتر است. این بیماری به دلیل تخریب نورونهای تولیدکننده دوپامین ایجاد میشود، و سلولهای بنیادی میتوانند بهصورت تئوری این نورونها را جایگزین کنند.
استاد دانشگاه علوم پزشکی آزاد تهران اینطور توضیح داد: «کارآزماییهای بالینی برای پارکینسون هنوز در مراحل اولیه هستند. نتایج آزمایشگاهی و پیشبالینی امیدوارکنندهاند، اما هنوز نمیتوانیم بگوییم که این بیماری کاملاً قابل درمان است. با این حال، میتوانیم امیدوار باشیم که در آینده شدت علائم را کاهش دهیم یا پیشرفت بیماری را کند کنیم، اما شاید چشمگیرترین پیشرفتها در درمان فلج نخاعی باشد. آسیبهای نخاعی، که اغلب در اثر تصادفات یا ضربههای شدید ایجاد میشوند، مشکلات حرکتی و پزشکی متعددی به همراه دارند.»
صادقی گفت: «در سال ۲۰۲۱، یک تیم تحقیقاتی ژاپنی، فلج نخاعی را روی چهار بیمار آزمایش کرد. آنها از سلولهای بنیادی خون بند ناف استفاده کردند و نتایج شگفتانگیز بود: یک بیمار کاملاً بهبود یافت، یک نفر ۷۰ درصد بهبودی نشان داد، و دو نفر پاسخ ندادند. سلولهای بنیادی، بهویژه از خون بند ناف، میتوانند به سلولهای عصبی یا گلیال تبدیل شوند و مسیرهای عصبی آسیبدیده را ترمیم کنند؛ این درمان هنوز در همه بیماران موفق نیست، اما نشان میدهد که میتوانیم حرکت را به برخی بیماران بازگردانیم. این برای بیمارانی که سالها ناتوان بودهاند، یک معجزه است.»
با این حال، او تأکید کرد که این درمانها زمانبر و پرهزینهاند و نیاز به تحقیقات بیشتری دارند. بازسازی بافت عصبی پیچیدهتر از بافتهای دیگر است. اما هر قدم ما را به درمانهای موثرتر نزدیکتر میکند.
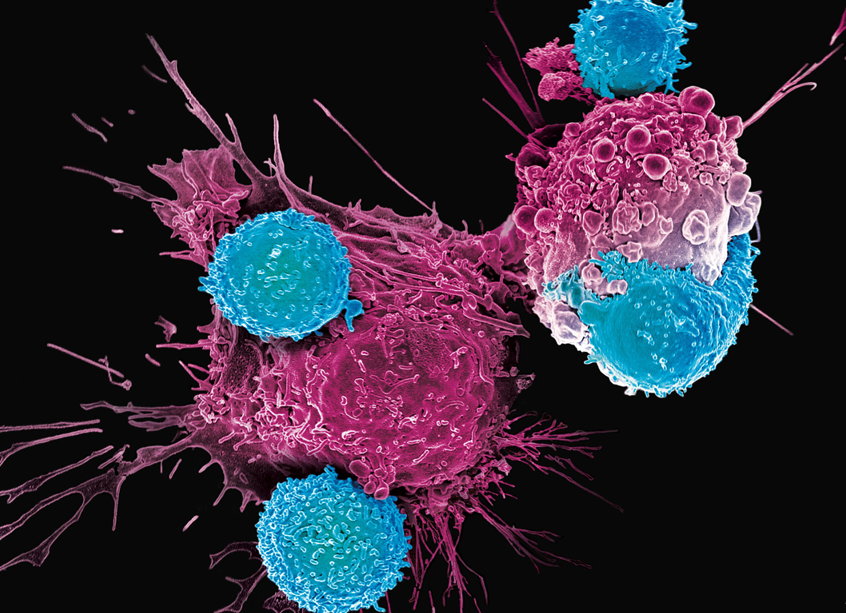
«CAR-T»: سلاح جدید علیه سرطان
در کنار سلولهای بنیادی، فناوری «CAR-T» بهعنوان یکی از پیشرفتهترین روشهای ایمونوتراپی، در درمان سرطانهای خونی موفقیتهای چشمگیری داشته است. اما این فناوری چیست و چگونه کار میکند؟
صادقی گفت: «این روش نوعی سلولدرمانی است که در آن سلولهای T (یکی از سلولهای سیستم ایمنی) بیمار را جمعآوری میکنیم، در آزمایشگاه آنها را مهندسی ژنتیک میکنیم تا گیرندهای به نام CAR (گیرنده آنتیژن کایمریک) داشته باشند، و بعد به بدن بیمار برمیگردانیم. این سلولها مثل سربازهای آموزشدیده، سلولهای سرطانی را پیدا میکنند و نابود میکنند این روش بهویژه در درمان سرطانهای خونی مثل لنفوم.
اما چرا این روش در همه بیماران موفق نیست؟
صادقی ادامه داد: «شکست درمان به دو عامل اصلی بستگی دارد: ویژگیهای تومور و خود سلولهای مهندسیشده. گاهی سلولهای سرطانی آنتیژنهای خود را تغییر میدهند تا از شناسایی توسط سلولهای CAR-T فرار کنند. در موارد دیگر، سلولهای T مهندسیشده به مرور زمان خسته میشوند و قدرت حملهشان کاهش مییابد.»
او به مشکل دیگری هم اشاره کرد: پاسخهای ناقص و در این مورد توضیح داد: «در برخی بیماران، CAR-T بار تومور را کاهش میدهد، اما نمیتواند سرطان را کاملاً نابود کند. این میتواند به پیشرفت دوباره سرطان منجر شود چالشهای ایمنی هم کم نیستند. تولید انبوه سلولهای مهندسیشده دشوار است و تزریق آنها گاهی عوارضی مثل واکنشهای ایمنی شدید ایجاد میکند. ما در حال کار روی روشهایی هستیم که این عوارض را کاهش دهد، مثلاً با بهبود طراحی گیرندههای CAR یا ترکیب CAR-T با درمانهای دیگر.»
چالشها و چشمانداز آینده
با وجود پیشرفتهای خیرهکننده، سلولهای بنیادی و CAR-T هنوز راه درازی در پیش دارند.
استاد دانشگاه علوم تحقیقات گفت: «یکی از بزرگترین چالشها، بهینهسازی روشهای استخراج و کشت سلولهاست. برای سلولهای بالغ، هنوز فناوریهای موثری برای کشت انبوه نداریم. در CAR-T هم، هزینههای بالا و پیچیدگیهای تولید، دسترسی بیماران را محدود کرده است.»
او با اشاره به مسائل اخلاقی، بهویژه در استفاده از سلولهای جنینی، توضیح داد: «استفاده از جنینهای باقیمانده از IVF بحثهای اخلاقی زیادی ایجاد کرده. به همین دلیل، روشهایی مثل سلولهای پرتوان القایی که نیاز به جنین ندارند، بسیار مورد توجه قرار گرفتهاند.»
شیدا صادقی با ابراز امیدواری نسبت به آینده؛ گفت: «هر روز که میگذرد، ما به درمانهای موثرتر نزدیکتر میشویم. در آینده، ممکن است بتوانیم بیماریهایی مثل آلزایمر، دیابت یا حتی سرطانهای پیشرفته را با سلولدرمانی درمان کنیم. این فناوریها نهتنها جان بیماران را نجات میدهند، بلکه کیفیت زندگی آنها را هم بهبود میبخشند. ما نیاز به سرمایهگذاری بیشتر در تحقیقات و زیرساختها داریم. اگر این اتفاق بیفتد، سلولهای بنیادی و CAR-T میتوانند به استاندارد جدید درمان در پزشکی تبدیل شوند.»
سلولهای بنیادی و CAR-T مثل دو بال برای پرواز پزشکی مدرن به سوی آیندهای روشن هستند. از درمان دیابت نوع یک تا بازگرداندن حرکت به بیماران فلج نخاعی، و از نبرد با لوسمی تا امید به درمان پارکینسون، این فناوریها نشان دادهاند که غیرممکنها ممکن میشوند. اما همانطور که پژوهشگران تأکید کردند، این مسیر پر از چالشهای علمی، فنی و اخلاقی است. با این حال، هر قدم در این راه، ما را به روزی نزدیکتر میکند که بیماریهای لاعلاج، دیگر فقط نامی در کتابهای پزشکی باشند.
انتهای پیام/