دانشمندان محافظان سرطان را علیه خود سرطان به کار گرفتند
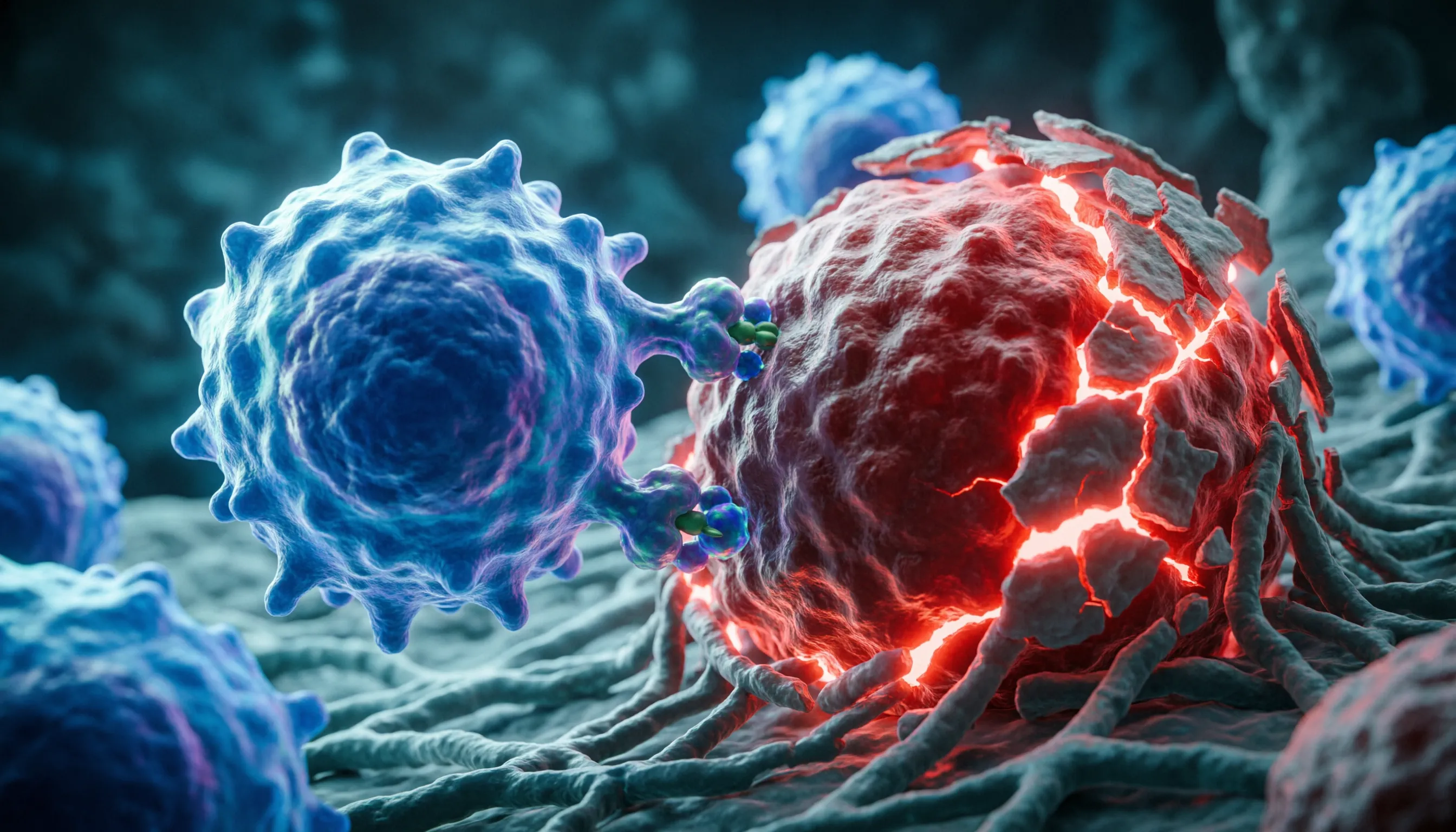
پژوهشگران در مدرسه پزشکی آیکان در ماونت ساینای یک ایمنیدرمانی آزمایشی توسعه دادهاند که به شیوهای غیرمنتظره با سرطان متاستاتیک مقابله میکند. براساس گزارش «سایتکدیلی» به جای حمله به خود سلولهای سرطانی، این درمان بر سلولهایی تمرکز دارد که آنها را احاطه کرده و از آنها محافظت میکنند.
سرطان متاستاتیک چیست؟
براساس تعریف مؤسسه ملی سلامت آمریکا، سرطانی که از محل اولیه بروز خود به بخش دوردستی از بدن گسترش مییابد، «سرطان متاستاتیک» نامیده میشود. در بسیاری از انواع سرطان، به آن «مرحله چهار» نیز گفته میشود. فرایندی که طی آن سلولهای سرطانی به سایر بخشهای بدن منتشر میشوند، «متاستاز» نام دارد.
سلولهای سرطان متاستاتیک هنگام مشاهده زیر میکروسکوپ و در آزمایشهای دیگر، ویژگیهایی مشابه سرطان اولیه را دارند و شبیه سلولهای بافتی نیستند که در آنجا یافت شدهاند. پزشکان از همین طریق تشخیص میدهند که سرطان از نقطهای دیگر در بدن گسترش یافته است. سرطان متاستاتیک همان نام سرطان اولیه را حفظ میکند. برای مثال، اگر سرطان سینه به ریه گسترش یابد، «سرطان سینه متاستاتیک» نامیده میشود، نه سرطان ریه. طبق یافتههای این پژوهش جدید که در نشریه «کنسر سل» (Cancer Cell)، یکی از مجلات Cell Press، منتشر شده است این درمان در مدلهای پیشبالینی تهاجمی سرطان متاستاتیک تخمدان و ریه آزموده شد و نتایج به یک راهبرد بالقوه جدید برای درمان تومورهای جامد پیشرفته اشاره دارد.
نفوذ به سپر ایمنی سرطان
این مفهوم از اسب تروا الهام گرفته شده است. به جای آنکه درمان تلاش کند با زور وارد تومورها شود، از طریق هدف قرار دادن ماکروفاژها — سلولهای ایمنی که به عنوان نگهبانان سلولهای سرطانی عمل میکنند — وارد میشود. با غیرفعال کردن این محافظان، درمان راه را برای حمله ایمنی باز میکند و به دفاعهای بدن اجازه میدهد وارد شده و سرطان را نابود کنند.
بیماری متاستاتیک عامل اکثر مرگهای ناشی از سرطان است. تومورهای جامد (توده غیرطبیعی از بافت که معمولا حاوی کیست یا نواحی مایع نیست) مانند سرطان ریه و تخمدان به ویژه در برابر بسیاری از ایمنیدرمانیهای کنونی مقاوم بودهاند. به گفته پژوهشگران، یکی از دلایل این امر آن است که تومورها به طور فعال فعالیت ایمنی را در محیط پیرامون خود سرکوب میکنند و یک سد محافظتی پیرامون سلولهای سرطانی ایجاد میکنند.
دکتر «خایمه ماتئوس-تیک»، نویسنده اصلی پژوهش و عضو هیئت علمی ایمنیشناسی و ایمنیدرمانی در مدرسه پزشکی آیکان در ماونت ساینای میگوید: «آنچه ما تومور مینامیم در واقع سلولهای سرطانی هستند که توسط سلولهایی احاطه شدهاند که آنها را تغذیه و محافظت میکنند. این یک دژ دیوار کشیده شده است. با ایمنیدرمانی، ما مرتبا با همان مشکل روبهرو میشدیم؛ نمیتوانیم از نگهبانان این دژ عبور کنیم؛ بنابراین فکر کردیم اگر این نگهبانان را هدف قرار دهیم، آنها را از محافظ به دوست تبدیل کنیم و از آنها بهعنوان دروازهای برای وارد کردن نیرویی ویرانگر به درون دژ استفاده کنیم، چه میشود؟».
نقش ماکروفاژهای توموری
این به اصطلاح نگهبانان ماکروفاژهای توموری هستند. در شرایط طبیعی، ماکروفاژها به عنوان نخستین پاسخدهندگان عمل میکنند و به مبارزه با عفونتها و ترمیم آسیب بافتی کمک میکنند. با این حال، درون تومورها، این سلولها به گونهای بازبرنامهریزی میشوند که عکس این کار عمل کنند. به جای حمایت از پاسخ ایمنی، آن را مسدود میکنند و به رشد و گسترش سرطان کمک میکنند.
برای مقابله با این وضعیت، تیم پژوهشی درمانی طراحی کرد که برای حذف ماکروفاژهای توموری در نظر گرفته شده است، در حالی که ماکروفاژهای سالم را دستنخورده باقی میگذارد. این تغییر، محیط تومور را از حالت سرکوب ایمنی به حالت فعال ایمنی تبدیل میکند.
مهندسی سلولهای CAR-T (کار-تی) برای هدفگیری سلولهای پشتیبان
این رویکرد از سلولهای CAR T استفاده میکند که از سلولهای T خودِ بیمار مهندسی میشوند. به طور سنتی، درمانهای CAR T به گونهای ساخته میشوند که سلولهای سرطانی را مستقیما شناسایی و نابود کنند. با این حال، برای بسیاری از تومورهای جامد، شناسایی اهداف مناسب روی خود سلولهای سرطانی دشوار بوده است. در این مورد، تیم پژوهشی سلولهای CAR T را هدایت مجدد کرد تا به جای آن، ماکروفاژهای توموری را شناسایی کنند.
پژوهشگران همچنین سلولهای CAR T را اصلاح کردند تا اینترلوکین-۱۲ را آزاد کنند؛ یعنی مولکول فعالکننده ایمنی قدرتمندی که سلولهای T کشنده را تحریک میکند. در موشهای مبتلا به سرطانهای متاستاتیک ریه و تخمدان، درمان با سلولهای CAR T مهندسیشده نتایج چشمگیری ایجاد کرد. این حیوانات ماهها بیشتر زنده ماندند و بسیاری به طور کامل درمان شدند.
بازآرایی ریزمحیط تومور
برای درک بهتر آنچه درون تومورها رخ میداد، دانشمندان از تکنیکهای پیشرفته ژنومیک فضایی استفاده کردند. طبق تعریف «موسسه زیستشناسی فضایی بروکر»، ژنومیک فضایی به معنای بررسی ژنها و فعالیت آنها در همان جایی از بدن است که واقعا قرار دارند. به زبان ساده، این علم نگاه میکند که هر سلول در چه مکانی است و در همان موقعیت، کدام ژنهایش فعال هستند.
در زیستشناسی یک اصل مهم وجود دارد: جایگاه و شکل هر چیز روی عملکرد آن تأثیر میگذارد؛ بنابراین اینکه یک سلول دقیقاً کجا قرار دارد، میتواند روی نحوه کار کردنش اثر بگذارد. ژنومیک فضایی کمک میکند بفهمیم سلولها در جای واقعی خودشان چگونه رفتار میکنند. برای این کار، دانشمندان از روشهای پیشرفته آزمایشگاهی استفاده میکنند تا بدون بههمزدن ساختار بافت، فعالیت ژنها را بررسی کنند.
نتایج بهکارگیری ژنومیک فضایی
تجزیه و تحلیل آنها نشان داد که درمان، ریزمحیط تومور را بازآرایی کرده است. سلولهای سرکوبکننده ایمنی کاهش یافتند و در مقابل، سلولهای ایمنیِ قادر به حمله به سرطان به درون تومور جذب شدند. این تغییر از آن جهت مهم است که درمان را «مستقل از آنتیژن» میکند؛ به این معنا که به شناسایی نشانگرهای اختصاصی سرطان متکی نیست. در نتیجه، ممکن است به طور بالقوه علیه طیف گستردهای از سرطانها، از جمله آنهایی که به سایر ایمنیدرمانیها پاسخ ندادهاند، به کار رود. به گفته پژوهشگران، همین راهبرد در هر دو مدل سرطان ریه و تخمدان موثر واقع شد که نشاندهنده ظرفیت گستردهتر آن است.
«برایان براون»، نویسنده ارشد پژوهش و استاد مهندسی ژنتیک در مدرسه پزشکی آیکان در ماونت ساینای میگوید: «ماکروفاژها در هر نوع توموری یافت میشوند و گاهی از سلولهای سرطانی نیز بیشتر هستند. آنها آنجا هستند؛ زیرا تومور از آنها به عنوان سپر استفاده میکند. آنچه بسیار هیجانانگیز است این است که درمان ما این سلولها را از نقش محافظت از سرطان خارج کرده و آنها را به سلولهای نابودکننده سرطان تبدیل میکند. ما دشمن را به متحد تبدیل کردهایم».
نتایج مرحله اولیه و گامهای بعدی
پژوهشگران هشدار میدهند که هنوز مطالعات روی انسان لازم است تا مشخص شود آیا این درمان برای بیماران ایمن و موثر خواهد بود یا خیر. این یافتهها بیانگر اثبات مفهوم هستند، نه یک درمان قطعی.
دکتر براون میگوید: «این کار شیوهای جدید برای درمان سرطان ایجاد میکند. با هدف قرار دادن ماکروفاژهای توموری، ما نشان دادهایم که ممکن است بتوان سرطانهایی را که به سایر ایمنیدرمانیها مقاوم هستند حذف کرد».
تیم پژوهشی به بهینهسازی درمان ادامه میدهد و بر کنترل بهتر محل و چگونگی آزادسازی IL-۱۲ درون تومورها در مدلهای موشی تمرکز دارد. هدف، بیشینهسازی اثرات ضدسرطانی در عین حفظ ایمنی است، در حالی که درمان به آزمایش احتمالی در انسان نزدیکتر میشود. فراتر از سرطان ریه و تخمدان، پژوهشگران بر این باورند که این رویکرد میتواند مبنای درمانهای آینده CAR T باشد که با هدف قرار دادن سلولهای پشتیبان تومور به جای صرفا سلولهای سرطانی، ریزمحیط تومور را بازآرایی میکنند.
انتهای پیام/